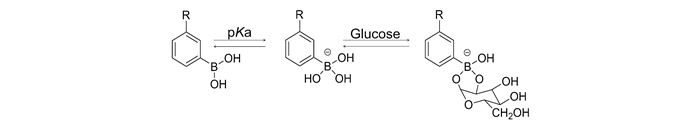
 圖?1? PBA與葡萄糖的相互作用示意圖[22] Figure?1.? Schematic interaction between PBA and glucose[22]
圖?1? PBA與葡萄糖的相互作用示意圖[22] Figure?1.? Schematic interaction between PBA and glucose[22] 糖尿病是一種以長期慢性高血糖為特征的代謝性疾病,這種疾病因胰島素分泌異常和(或)胰島素抵抗而引起糖類、蛋白質(zhì)和脂肪等代謝異常,久病可導致血管、心臟、神經(jīng)、腎臟、眼等組織器官的慢性并發(fā)癥,嚴重威脅著人類的健康。隨著生活水平的提高、人口老齡化與生活方式的改變,糖尿病患病率逐年上升,成為繼心血管疾病和癌癥之后排名第三的人類健康殺手,帶給社會和家庭沉重的負擔。數(shù)據(jù)表明,截止至2013年,全球糖尿病患者數(shù)已達3.82億,預計2035年全球糖尿病患者數(shù)將達到5.92億[1–3]。因此,糖尿病防治已經(jīng)成為一個亟待解決的醫(yī)學和社會問題。原發(fā)性糖尿病分為1型糖尿病和2型糖尿病兩種。其中1型糖尿病是由淋巴細胞介導的、以免疫性胰島炎和選擇性胰島β細胞損傷為特征的自身免疫性疾病,約占糖尿病患者總數(shù)的5%~10%。2型糖尿病是由胰島β細胞分泌功能缺陷和(或)胰島素抵抗導致的胰島素相對不足而血糖升高的癥狀,約占糖尿病總?cè)藬?shù)的90%[4]。
目前,補充外源性胰島素是治療糖尿病最直接最有效的方法[5]。除常規(guī)注射給藥外,鼻腔給藥、超聲介導給藥甚至是皮下包埋等非注射胰島素給藥途徑逐漸受到青睞。但由于胰島素是蛋白類藥物,其相對分子質(zhì)量大、半衰期短、易變性以及脂溶性差,導致非注射給藥時生物利用度很低,并且受制藥技術的制約,這些非注射給藥途徑仍處于實驗研究階段[6–10]。在各種給藥途徑中,口服胰島素因其給藥方便且具有與內(nèi)源性胰島素相同的遞送機制而被認為是最合理的給藥途徑[11]。然而,實現(xiàn)口服胰島素給藥仍然存在兩個主要問題:一方面,胰島素在胃腸道強酸環(huán)境中易降解,胃腸道中pH梯度較大且存在許多水解蛋白酶,易使胰島素失活;另一方面,胰島素在小腸中不易被吸收,由于腸上皮和粘液層抑制大分子的運輸,導致胰島素不易滲透入血[12–13]。這些缺點限制了口服胰島素的臨床應用。皮下注射胰島素給藥仍是治療糖尿病的常規(guī)途徑。雖然皮下注射胰島素能夠快速降低血糖,但每日數(shù)次的注射帶給患者極大的身體和精神痛苦,長期使用病人的耐受性和依從性較差。故此,研究人員開始更多的關注可減少給藥次數(shù)的新型給藥方式。
從1954年Kuivila等[14]發(fā)現(xiàn)苯硼酸(PBA)與二元醇特異性結(jié)合這一特性開始,關于葡萄糖敏感PBA基高分子載藥材料的研究就從未停止。葡萄糖敏感藥物傳遞系統(tǒng)能夠模擬人體胰腺分泌胰島素的生理模式,根據(jù)血糖濃度的變化控制胰島素釋放并調(diào)控血糖水平,具有“人工胰腺”之稱。基于PBA的葡萄糖敏感高分子材料近年來備受關注,這是一種全合成的體系,具有體系穩(wěn)定、長期保存的特點,用于藥物的自調(diào)式控制釋放更具有可逆葡萄糖響應性的優(yōu)勢[15–16]。
PBA是一種路易斯酸,在藥物傳遞領域具有廣泛的應用[17–20]。PBA的pKa值的范圍在8.2~8.6[21]。在水溶液中,PBA有未電離的平面三角形的疏水形式和電離的立體正四面體的親水形式兩種存在方式,且這兩種形式間存在可逆的動態(tài)平衡[22–23]。這兩種形式均能夠與1, 2-二元醇或多元醇(葡萄糖等)特異性結(jié)合形成五元或六元環(huán)的苯硼酸酯復合物。但電離形式的PBA與葡萄糖形成的苯硼酸酯親水性更好,結(jié)構(gòu)更加穩(wěn)定(圖 1)。當溶液pH值大于PBA的pKa時,PBA主要以帶電的相對親水的構(gòu)型存在。此時,PBA功能化的載體與葡萄糖特異性結(jié)合后可形成親水性較強的苯硼酸酯,使得PBA的電離平衡正向移動,增加了電離形式PBA的比例。這種電離平衡正向移動提高了PBA功能化載體材料的親水性,且PBA由平面三角形轉(zhuǎn)化為立體的正四面體結(jié)構(gòu)增大了載體材料的空間體積。兩種作用均使得藥物載體響應葡萄糖濃度的變化而將所擔載的藥物釋放出來,且葡萄糖濃度越大藥物釋放速度越快,釋放總量越大。除此之外,采用特殊的結(jié)構(gòu)設計,PBA功能化的藥物載體在葡萄糖存在下也會因收縮而將藥物釋放出來[24]。這種與二元醇特異性結(jié)合的特性使PBA功能化的載體擁有良好的葡萄糖敏感性能,使得PBA及其衍生物在葡萄糖敏感藥物傳遞系統(tǒng)中具有極大的應用潛力[25–28]。經(jīng)過不斷的努力,PBA基葡萄糖敏感的水凝膠、微凝膠、納米載體等均取得較大的進展[29–32]。但PBA基納米載體因其較長的血液循環(huán)時間和高載藥量等受到研究者更廣泛的關注[33–34]。
 圖?1? PBA與葡萄糖的相互作用示意圖[22] Figure?1.? Schematic interaction between PBA and glucose[22]
圖?1? PBA與葡萄糖的相互作用示意圖[22] Figure?1.? Schematic interaction between PBA and glucose[22]
盡管如此,將PBA及其衍生物應用于糖尿病治療的葡萄糖敏感藥物傳輸體系還面臨許多困難,諸如葡萄糖響應的pH高于生理pH和葡萄糖響應濃度遠高于糖尿病患者的血糖水平[35]。因此,研究者們將具有環(huán)境敏感性能的單體或聚合物接枝或共聚到PBA及其衍生物體系中而得到納米載體,并通過這些功能化的基團感應外界環(huán)境因素的變化來控制藥物釋放速率。按照響應因素不同,可將PBA基葡萄糖敏感納米藥物載體分為pH響應、溫度響應、光響應等類型。本文重點介紹基于PBA的葡萄糖敏感高分子納米藥物載體的發(fā)展過程和應用,并對該領域的發(fā)展前景進行展望。
1?? 葡萄糖敏感PBA基高分子納米藥物載體
1.1?? pH響應型PBA基葡萄糖敏感納米藥物載體
PBA基葡萄糖敏感藥物載體應用于糖尿病治療的前提是降低其pKa值,以實現(xiàn)生理pH下的葡萄糖敏感性能[36]。通過在PBA上引入羧基[21, 37]、氨基或硝基[29, 38]等基團可以降低PBA的pKa值,得到生理pH下具有較好葡萄糖敏感藥物釋放性能的高分子納米載體。
本課題組通過開環(huán)聚合并經(jīng)過PBA修飾得到聚乙二醇單甲醚-block-聚(L-谷氨酸-co-谷氨酰胺基苯硼酸)(mPEG-b-P(GA-co-GPBA))嵌段共聚物,該嵌段共聚物可自組裝成納米膠束[39]。此膠束在生理pH下可依據(jù)葡萄糖濃度的變化而控制胰島素的釋放,呈現(xiàn)出“開-關”式釋放的特性。
Yang等[40]采用原子轉(zhuǎn)移自由基聚合(ATRP)方法,以單甲氧基聚乙二醇-溴(mPEG5000-Br)為引發(fā)劑,引發(fā)自制單體(2-苯硼酸酯-1, 3-二噁烷-5-乙基)丙烯酸甲基酯(PBDEMA)聚合,制備了嵌段共聚物mPEG5000–b-PPBDEMA。該共聚物自組裝成的納米膠束在遇到葡萄糖分子時,膠束內(nèi)核處苯硼酸酯基團的斷裂增加了膠束的親水性和體積,甚至可使膠束解體。這種膠束在pH=7.4時短時間內(nèi)即可展現(xiàn)出良好的葡萄糖響應性并快速釋放藥物,且藥物釋放具有“開-關”式的特性。
同樣采用ATRP聚合方法,Shi課題組[37]用引發(fā)劑PEG-Br引發(fā)丙烯酸叔丁酯聚合并經(jīng)過功能化修飾,得到聚(乙二醇)-block-聚(丙烯酸-co-丙烯酰胺基苯硼酸)(PEG-b-P(AA-co-AAPBA))嵌段共聚物。該嵌段共聚物可自組裝成“核-殼”結(jié)構(gòu)的納米膠束,且膠束以P(AA-co-AAPBA)為內(nèi)核,以PEG為外殼。羧基和硼原子的配位作用可降低PBA的pKa。當PBA的修飾率為63%時,納米膠束在生理pH值條件下具有良好的葡萄糖敏感藥物釋放性能。在此基礎上,該課題組還進行了更深入的研究,制備了可增強葡萄糖敏感性能的苯硼酸-糖聚物納米復合膠束[41–42](圖 2)。通過聚丙烯酸(PAA)接枝2-氨基葡萄糖(AGA)得到糖基化聚合物P(AA-co-AGA)。將上述糖基化聚合物與PEG-b-P(AA-co-AAPBA)復合,最終得到內(nèi)核為P(AA-co-APBA)/P(AA-co-AGA)、外殼為PEG的復合納米膠束。和單一膠束相比,該復合納米膠束的穩(wěn)定性和生物相容性更好,為葡萄糖敏感聚合物的構(gòu)筑提供了一種新的思路。
 圖?2? P(AA-co-APBA)/P(AA-co-AGA)復合微凝膠粒的形成和葡萄糖響應性崩解示意圖(A)。在pH=7.4,葡萄糖濃度=2 g/L的PBS中,不同比例PEG-b-P(AA-co-APBA)/P(AA-co-AGA)(w/w)復合膠束的葡萄糖響應性(B)[41] Figure?2.? Schematic illustration for formation and glucose-disintegration of PEG-b-P(AA-co-APBA)/P(AA-co-AGA) complex micelle(A). Glucose-responsiveness of PEG-b-P(AA-co-APBA)/P(AA-co-AGA)(w/w) micelle in aqueous solution of PBS at 7.4 with the concentration of glucose is 2 g/L(B)[41]
圖?2? P(AA-co-APBA)/P(AA-co-AGA)復合微凝膠粒的形成和葡萄糖響應性崩解示意圖(A)。在pH=7.4,葡萄糖濃度=2 g/L的PBS中,不同比例PEG-b-P(AA-co-APBA)/P(AA-co-AGA)(w/w)復合膠束的葡萄糖響應性(B)[41] Figure?2.? Schematic illustration for formation and glucose-disintegration of PEG-b-P(AA-co-APBA)/P(AA-co-AGA) complex micelle(A). Glucose-responsiveness of PEG-b-P(AA-co-APBA)/P(AA-co-AGA)(w/w) micelle in aqueous solution of PBS at 7.4 with the concentration of glucose is 2 g/L(B)[41]
除了ATRP聚合方法之外,采用可逆加成-斷裂轉(zhuǎn)移自由基聚合(RAFT)也是制備葡萄糖敏感嵌段共聚物的有效方法[43–46]。通過RAFT聚合方法,Kim等[47]得到可自組裝成納米囊泡的嵌段共聚物聚苯乙烯硼氧烷(PEG-b-PBOx)。在生理pH條件下,組成囊泡的PBA基團與單糖相互作用,使囊泡解體并釋放出被標記的胰島素。而在沒有單糖和(或)1<pH<7時,則無胰島素釋放。這種PBA共聚物自組裝的納米囊泡載藥率較高,在藥物傳遞領域具有很好的應用前景。
近年來,介孔二氧化硅(MSN)在組織工程和藥物傳遞領域備受青睞[48–49]。MSN具有極好的生物相容性和可調(diào)的介孔尺寸,且孔隙率較大,可修飾性較強。許多研究者將PBA功能化的MSN用于葡萄糖敏感藥物傳輸體系,可獲得具有較好藥物緩釋特性的納米雜化粒子[50–51]。
Liu等[52]采用MSN設計了新型的葡萄糖和pH雙敏感聚合物包覆雜化納米顆粒(圖 3)。MSN上的聚合物刷是EPBA交聯(lián)的P(AA-AGA)。該聚合物刷包覆在MSN的表面起到“蓋子”的作用,并將模型藥物Rhodamine 6G(Rd6G)包埋在MSN內(nèi)部的空隙中。在葡萄糖溶液中,葡萄糖分子可取代聚合物上的糖基元競爭性與PBA結(jié)合,而這種競爭性結(jié)合可以掀開MSN的“蓋子”,使包埋在MSN中的藥物釋放出來。在pH值低于EPBA的pKa的酸性溶液中,EPBA與聚合物刷上糖基元的特異性結(jié)合會受到破壞,所以該MSN的藥物釋放行為還受溶液pH值的影響。在葡萄糖濃度相同的情況下,Rd6G的釋放速率隨著溶液pH的降低而加快。
 圖?3? 在pH=7.4的PBS溶液中,不同葡萄糖濃度下MSN-PAA-AGA粒子釋放Rd6G的總量[52] Figure?3.? Cumulative release of Rd6G from MSN-PAA-AGA in PBS(pH=7.4) with different concentrations of glucose[52]
圖?3? 在pH=7.4的PBS溶液中,不同葡萄糖濃度下MSN-PAA-AGA粒子釋放Rd6G的總量[52] Figure?3.? Cumulative release of Rd6G from MSN-PAA-AGA in PBS(pH=7.4) with different concentrations of glucose[52]
1.2?? 溫度響應型PBA基葡萄糖敏感納米藥物載體
為了在人體生理溫度條件下得到合適的PBA衍生物用于葡萄糖敏感藥物傳輸載體,科研工作者進行了大量的研究。
采用開環(huán)聚合方式,Shi等[53]利用聚異丙基丙烯酰胺(PNIPAM)的溫度響應特性,制備了聚乙二醇-block-聚(天冬氨酸-co-天冬酰胺基苯硼酸)(PEG-b-P(Asp-co-AspPBA))和聚異丙基丙烯酰胺-block-聚(天冬氨酸-co-天冬酰胺基苯硼酸)(PNIPAM-b-P(Asp-co-AspPBA))嵌段共聚物。這兩種共聚物可自組裝成納米復合膠束(圖 4)。這種納米復合膠束的內(nèi)核由疏水的P(Asp-co-AspPBA)組成,而外殼則由PEG/PNIPAM復合而成,形成經(jīng)典的“核-殼”結(jié)構(gòu)。在溫度37 ℃時,溫敏性的PNIPAM層塌縮在膠束內(nèi)核的表面并形成一層連續(xù)的膜結(jié)構(gòu)。在聚合物膠束內(nèi)核和PNIPAM膜層中間則是PEG層,復合膠束由經(jīng)典的“核-殼”結(jié)構(gòu)轉(zhuǎn)變?yōu)樘厥獾摹昂?殼-冠”結(jié)構(gòu)(圖 4)。該復合膠束結(jié)構(gòu)穩(wěn)定,可表現(xiàn)出可逆的葡萄糖響應性溶脹行為,更重要的是具有反復“開-關”式釋放胰島素的特性。此外,連續(xù)的PNIPAM膜能夠保護包載的藥物免受酶的降解而保持原有的生物活性。在此基礎上,該課題組[54]還利用環(huán)糊精主客體相互作用的特性制備了葡萄糖敏感的聚合物囊泡來提高載藥率。首先制備了含葡萄糖胺的共聚物聚(乙二醇)-block-聚(天冬氨酸-co-天冬酰胺基葡萄糖)(PEG45–b-P(Asp-co-AspGA)),然后通過加入α-環(huán)糊精(α-CD)利用主-客體相互作用形成具有“核-殼-冠”結(jié)構(gòu)的PEG45–b-P(Asp-co-AspGA)膠束。當移除α-CD后,得到內(nèi)、外層均由PEG組成、而中間層為P(Asp-co-AspGA)/P(Asp-co-AspPBA)的納米囊泡,囊泡殼層中天冬酰胺基葡萄糖的GA和PBA可特異性結(jié)合形成苯硼酸酯并增強殼層的穩(wěn)定性。該囊泡具有較好的葡萄糖敏感性能。除此之外,該課題組[55]將PEG45–b-P(Asp-co-AspGA)加入到熱敏感聚合物膠束PNIPAM-b-P(Asp-co-AspPBA)中得到“核-殼-冠”結(jié)構(gòu)的納米復合膠束。“核-殼-冠”結(jié)構(gòu)的納米復合膠束在低于PNIPAM的最低共溶溫度(LCST)時則形成聚合物囊泡。該聚合物囊泡具有膨脹的PNIPAM內(nèi)層、交聯(lián)的P(Asp-co-AspGA)/P(Asp-co-AspPBA)膜以及PEG冠層結(jié)構(gòu)。利用PNIPAM的溫敏性制備具有特殊結(jié)構(gòu)的葡萄糖敏感納米載體材料可自調(diào)式“開-關”控制胰島素釋放,并保護藥物免受酶的降解,在糖尿病治療方面具有較大的潛在應用價值。
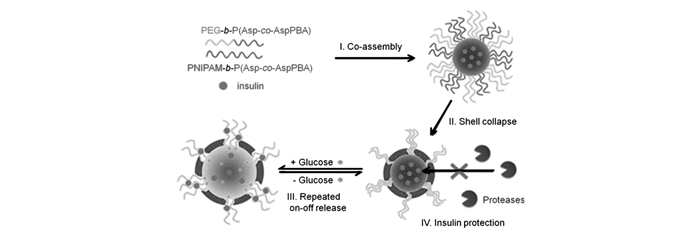 圖?4? 葡萄糖敏感復合聚合物膠束用于生理條件下可重復“開-關”胰島素釋放和胰島素保護[53] Figure?4.? Schematic illustration of glucose-responsive complex polymeric micelle(CPM) for repeated “on-off” release and insulin protection under physiological conditions[53]
圖?4? 葡萄糖敏感復合聚合物膠束用于生理條件下可重復“開-關”胰島素釋放和胰島素保護[53] Figure?4.? Schematic illustration of glucose-responsive complex polymeric micelle(CPM) for repeated “on-off” release and insulin protection under physiological conditions[53]
1.3?? 光響應型PBA基葡萄糖敏感納米藥物載體
光響應型藥物釋放體系具有較好的潛在應用前景,利用特定波長的光線作為刺激因素,引起聚合物載體響應性釋放藥物,成為一個有發(fā)展前景的研究方向[56]。光刺激是一種潔凈、無創(chuàng)、高效的刺激類型,光響應型高分子載體用于藥物的傳遞具有時間和空間上可控性,光療法也逐漸興起。以硝基苯衍生物為代表的光致斷裂型PBA功能化高分子材料也可用于葡萄糖敏感藥物釋放體系。Jiang課題組[57]通過實驗設計,采用RAFT聚合方法以聚(甲氧基聚乙二醇丙烯酰胺)(MePEGA)為引發(fā)劑,引發(fā)AAPBA和鄰硝基芐基丙烯酸酯(NBA)共聚,制備了MePEGA-b-(PNBA-co-PAAPBA)嵌段共聚物,該嵌段共聚物能夠自組裝成具有光-葡萄糖雙敏感的納米膠束。研究表明,在可見光照射下,30 min內(nèi)胰島素的累積釋放量僅為20%,而在紫外光(λmax=365 nm,75 mW/cm2)照射下,30 min內(nèi)胰島素的釋放總量則高達98%。紫外光促使藥物的快速釋放是由于在紫外光照射下,疏水的PNBA可轉(zhuǎn)變成親水性的PAA,聚合物的親疏水平衡發(fā)生向親水性方向的移動,從而使聚合物膠束的親水性增加并伴有胰島素的快速釋放。該聚合物也具有葡萄糖響應性胰島素的可控釋放性能。基于PBA與多元醇的特異性結(jié)合,在葡萄糖濃度為25 mmol/L的溶液中,胰島素的累積釋放量是不含葡萄糖的溶液中的18倍。這種紫外光和葡萄糖雙敏感的聚合物在自調(diào)式藥物控制釋放體系中具有極其重要的應用。
2?? PBA基葡萄糖敏感納米藥物載體的生物應用研究
除了良好的環(huán)境響應性藥物釋放性能外,材料的毒性及生物相容性是評價新型載體材料的另一個關鍵因素。生物相容性是生命體組織對非活性材料產(chǎn)生各種復雜的生物、物理、化學反應的一種性能,以及對這些反應的忍受程度[58]。良好的生物相容性是葡萄糖敏感藥物載體材料應用于胰島素自調(diào)式藥物傳遞系統(tǒng)的必要條件。
多聚糖及糖類聚合物具有較好的生物相容性和生物降解性,被廣泛應用于藥物傳遞系統(tǒng)[59]。采用RAFT聚合方法,Zhang等[60]制備了含糖共聚物聚丙烯酰胺基苯硼酸-block-聚(甲基丙烯酸2-(N-葡萄糖酰胺)乙酯)(P(AAPBA-b-GAMA))。聚合物上的PBA基團與類糖聚合物上的二羥基特異性結(jié)合,使共聚物自組裝成具有親水性的PGAMA冠和疏水的PAA-PBA核的交聯(lián)納米粒子(圖 5)。當葡萄糖分子存在時,游離的葡萄糖小分子將和類糖聚合物競爭性與PBA結(jié)合,從而使聚合物納米粒子疏松甚至解體。這種競爭性結(jié)合機制使得該交聯(lián)納米粒子具有良好的葡萄糖敏感性能。而GAMA作為一種可再生糖不僅可以降低共聚物的pKa,還可以降低生物毒性,提高共聚物的生物相容性[61]。這種葡萄糖敏感藥物控制釋放行為是可逆的,用于胰島素的擔載,納米載體可依據(jù)血糖變換調(diào)控胰島素的釋放并控制血糖穩(wěn)定減少血糖波動。這類智能藥物輸送系統(tǒng)在糖尿病治療中具有較大的應用潛力。
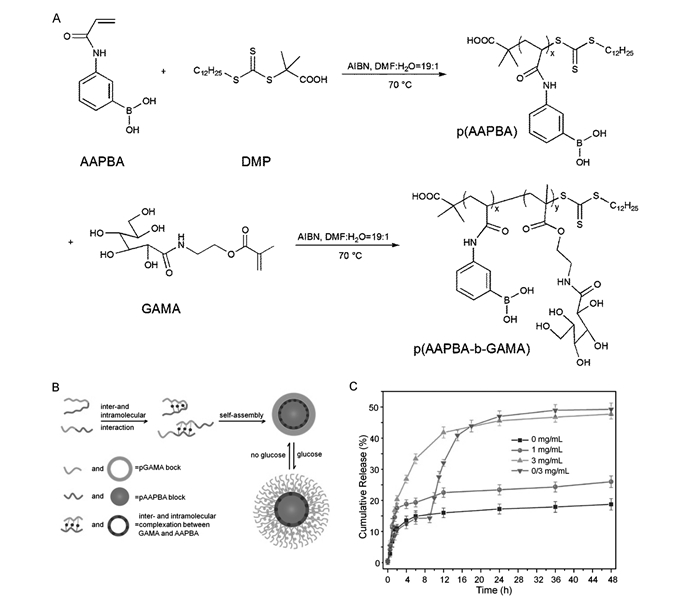 圖?5? P(AAPBA-b-GAMA)嵌段共聚物的合成(A),P(AAPBA-b-GAMA)納米粒子示意圖(B)和pH=7.4的PBS中葡萄糖響應納米粒子的胰島素釋放曲線(C)[60] Figure?5.? Synthesis of P(AAPBA-b-GAMA) block polymer(A), schematic representation for formation of P(AAPBA-b-GAMA) nanoparticle(B), and cumulative release of insulin in pH=7.4 PBS from nanoparticle triggered by glucose(C)[60]
圖?5? P(AAPBA-b-GAMA)嵌段共聚物的合成(A),P(AAPBA-b-GAMA)納米粒子示意圖(B)和pH=7.4的PBS中葡萄糖響應納米粒子的胰島素釋放曲線(C)[60] Figure?5.? Synthesis of P(AAPBA-b-GAMA) block polymer(A), schematic representation for formation of P(AAPBA-b-GAMA) nanoparticle(B), and cumulative release of insulin in pH=7.4 PBS from nanoparticle triggered by glucose(C)[60]
采用同樣的競爭性結(jié)合機制,Cheng等[62]報道了一種通過RAFT聚合得到的新型兩親性嵌段共聚物聚(甲基丙烯酸2-(N-乳糖酰胺)乙酯)-block-聚(3-丙烯酰胺基苯硼酸)(P(LAMA-b-AAPBA))。該兩親性嵌段共聚物能夠自組裝成較小尺寸的納米球,納米球的平均粒徑為238~403 nm。該納米球應用于胰島素的擔載能夠響應葡萄糖的刺激而快速釋放出藥物。此外,納米球中含糖聚合物與苯硼酸基團的結(jié)合不僅降低了苯硼酸的細胞毒性,還能夠促進細胞增殖,賦予納米球較好的生物相容性。該納米球具有較好的葡萄糖敏感藥物傳遞應用前景。
同樣利用含糖聚合物降低PBA的毒性,Li課題組[63]成功制備了PBA功能化的含糖聚合物聚(丙烯酸-co-丙烯酰胺基苯硼酸)-block-聚(2-丙烯酰基氧乙基半乳糖)(PAA-co-PAAPBA)-b-)2PAEG),該共聚物可自組裝成納米膠束。含糖聚合物的存在既可降低PBA的毒性,又賦予納米粒子良好的生物相容性。良好的pH和葡萄糖雙敏感性能使該納米膠束具有較好的應用前景。
含糖聚合物的加入提高了PBA基葡萄糖敏感聚合物材料的生物相容性和生物降解性,增大了其臨床應用的潛力。Wu等[64]設計了一種可注射的納米凝膠(P(NIPAM-Dex-PBA))。該納米凝膠由PNIPAM和AAPBA組成,并采用葡聚糖-馬來酸酐(Dex-Ma)進行交聯(lián)。用于胰島素的擔載,該納米凝膠可響應葡萄糖的刺激而釋放出胰島素,且納米凝膠中葡聚糖的含量越高葡萄糖敏感性能越好(圖 6A)。將可注射納米凝膠用于動物實驗,在糖尿病大鼠體內(nèi),該納米凝膠具有良好的降血糖效果。如圖 6B所示,載藥MG3納米凝膠具有較好的降血糖效果,且能夠保持血糖水平穩(wěn)定避免血糖的波動。該可注射納米凝膠推動了葡萄糖敏感胰島素自調(diào)式藥物傳遞系統(tǒng)的發(fā)展。
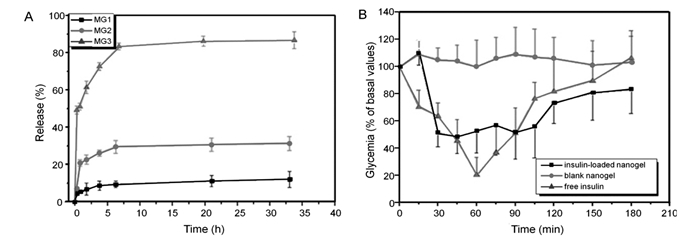 圖?6? 在pH=7.4、0.1 mol/L的PBS中(含2.0 mg/mL葡萄糖)的納米凝膠控制釋放胰島素的曲線(MG1、MG2和MG3為葡聚糖的含量增加的納米凝膠)(A)和經(jīng)皮下注射胰島素(2.0 IU/kg)、載胰島素MG3納米凝膠(4.0 IU/kg)和空白MG3納米凝膠處理后糖尿病大鼠的降血糖效果(B)[64] Figure?6.? In vitro release of insulin from MG1, MG2, and MG3 nanogels in 0.1 mol/L PBS at pH=7.4 with 2.0 mg/mL of glucose(MG1, MG2, and MG3 stand for P(NIPAM-Dex-PBA) nanogels with different dextran contents, and the dextran contents are MG3 > MG2 > MG1(A), and profiles of glycaemia after a subcutaneous administration of free insulin(2.0 IU/kg), insulin-loaded MG3 nanogel(4.0 IU/kg), and blank MG3 nanogel in fed diabetic rats(B)[64]
圖?6? 在pH=7.4、0.1 mol/L的PBS中(含2.0 mg/mL葡萄糖)的納米凝膠控制釋放胰島素的曲線(MG1、MG2和MG3為葡聚糖的含量增加的納米凝膠)(A)和經(jīng)皮下注射胰島素(2.0 IU/kg)、載胰島素MG3納米凝膠(4.0 IU/kg)和空白MG3納米凝膠處理后糖尿病大鼠的降血糖效果(B)[64] Figure?6.? In vitro release of insulin from MG1, MG2, and MG3 nanogels in 0.1 mol/L PBS at pH=7.4 with 2.0 mg/mL of glucose(MG1, MG2, and MG3 stand for P(NIPAM-Dex-PBA) nanogels with different dextran contents, and the dextran contents are MG3 > MG2 > MG1(A), and profiles of glycaemia after a subcutaneous administration of free insulin(2.0 IU/kg), insulin-loaded MG3 nanogel(4.0 IU/kg), and blank MG3 nanogel in fed diabetic rats(B)[64]
同樣利用糖類高分子材料,Kim等[65]設計了一種新型的聚氨基酸雙層納米凝膠。該課題組首先制備了海藻酸鈉接枝的聚(L-谷氨酸-co–N-3-L-谷氨酰胺基苯硼酸)(SA-PGGA),然后結(jié)合改性的殼聚糖(GC)制備了GC/SA-PGGA雙層納米凝膠。在葡萄糖溶液中,葡萄糖小分子取代殼聚糖上的糖基元與PBA競爭性結(jié)合生成苯硼酸酯,增加了納米凝膠的親水性并促使其釋放胰島素,且葡萄糖濃度越大胰島素的釋放速度越快。該課題組還進行了糖尿病小鼠的動物實驗,證實了該納米凝膠良好的降血糖效果。該GC/SA-PGGA雙層納米凝膠具有葡萄糖響應的胰島素自調(diào)式釋放特性,有望應用于糖尿病的治療。
除了含糖聚合物類材料,研究還發(fā)現(xiàn),聚氨基酸材料也具有良好的生物相容性和生物降解性,用于葡萄糖敏感的高分子納米材料可被廣泛應用于糖尿病藥物傳遞等生物醫(yī)學領域[66–68]。本課題組利用聚氨基酸的這一特性,設計了聚乙二醇單甲醚-block-聚(γ-苯甲基-L-谷氨酸酯-co-糖基化-L-谷氨酸酯)(mPEG-b-P(BLG-co-(PLG-g-Glu)))納米凝膠[69]。由于葡萄糖分子競爭性與PBA基團結(jié)合,使得納米凝膠具有良好的葡萄糖響應性,該納米凝膠可葡萄糖依賴性釋放出所擔載的胰島素。細胞毒性實驗及細胞溶血實驗證明了該納米凝膠良好的生物相容性。這類聚氨基酸葡萄糖敏感納米凝膠在糖尿病的治療方面具有一定的臨床應用價值。
3?? 總結(jié)與展望
葡萄糖敏感苯硼酸基高分子納米傳輸體系是一種自調(diào)式的藥物控制釋放系統(tǒng),將其用于糖尿病的治療,既可以減少胰島素的注射次數(shù)提高患者的順從性,又可依據(jù)血糖變化調(diào)控胰島素的釋放,減小血糖波動并降低并發(fā)癥的發(fā)生。因此,該藥物傳遞系統(tǒng)在糖尿病治療方面具有較大的應用前景。以上綜述了近幾年PBA基葡萄糖敏感納米藥物傳輸體系的研究進展。雖然不同環(huán)境響應性PBA基葡萄糖敏感納米材料的研究均取得了較大的進步,但仍然存在著一些問題亟待解決。
首先,生理條件下可逆的葡萄糖響應藥物釋放性能制約著藥物自調(diào)式控制釋放系統(tǒng)的發(fā)展。目前,為了提高PBA基納米材料在生理條件下的葡萄糖響應能力,眾多研究者做了大量的研究,包括在PBA功能化材料上引入特殊基團以降低其pKa,以及加入溫敏或光敏基團獲得雙響應性納米材料等等。然而,多環(huán)境因素敏感的葡萄糖響應藥物釋放傳輸體系的研究仍需加強。采用特殊巧妙的結(jié)構(gòu)設計,綜合環(huán)境敏感基團的優(yōu)勢,制備簡單而又易于重復獲得的納米載體,在此基礎上優(yōu)化選擇,相信獲得在生理條件下具有可逆葡萄糖敏感藥物釋放特性的藥物傳遞系統(tǒng)指日可待。
其次,葡萄糖敏感藥物傳遞系統(tǒng)給藥的精準性較差,仍然制約著該體系的發(fā)展。給藥的精準性主要受兩個方面影響:一方面,藥物的生物活性會受到包藥及釋放過程中一些不可控因素的影響而降低;另一方面,藥物載體無法準確按需釋放藥物。總而言之,葡萄糖敏感藥物載體成為真正的“人造胰腺”任重而道遠。獲得精準性藥物釋放的前提是葡萄糖敏感納米藥物載體的可重復制備。結(jié)構(gòu)簡單易于制備的聚合物用于納米載體控制藥物釋放更易于實現(xiàn)藥物的精準傳遞。除此之外,藥物制劑制備方法的優(yōu)化也是提高給藥精準性的有效途徑。
最后,盡管大量體內(nèi)外實驗證明PBA具有良好的生物相容性,但是對PBA基高分子納米載體的評價大多止步于簡單的細胞毒性測試。因此,另一個研究重點是使藥物載體真正用于糖尿病治療時不具有毒副作用,并能夠及時排出體外,保證其具有較好的生物相容性和生物降解性。除了細胞毒性測試,研究者應該更多地關注材料的溶血性能以及和血液蛋白的相互作用,進一步考察納米載體的生物相容性。在此基礎上,考察葡萄糖敏感納米載體的動物實驗以深入考察納米載體的安全性和降血糖效果,推動PBA基葡萄糖敏感納米載體的臨床應用。
盡管葡萄糖敏感PBA基高分子納米材料傳遞體系還有各種不完善之處,但其在糖尿病治療方面仍具有巨大的應用潛力。
???????????????????????????????????????????????????????????????????????????????????????????????????? 化學慧定制合成事業(yè)部摘錄







