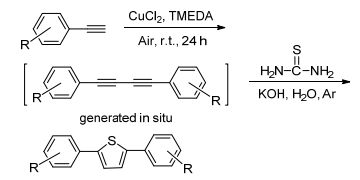
 圖式1? 2, 5-二芳基噻吩的合成設(shè)計 圖式1.? Design for syntheses of 2, 5-diarylthiophene
圖式1? 2, 5-二芳基噻吩的合成設(shè)計 圖式1.? Design for syntheses of 2, 5-diarylthiophene 噻吩是一個基本五元芳香雜環(huán), 含噻吩結(jié)構(gòu)的天然產(chǎn)物大多具有良好的生物活性, 而且噻吩衍生物的聚合物在現(xiàn)代光電子、微電子領(lǐng)域及現(xiàn)代醫(yī)學(xué)等領(lǐng)域中也具有誘人的應(yīng)用前景, 因而新噻吩衍生物和新合成方法的研究一直受到關(guān)注[1].噻吩及其衍生物的經(jīng)典制備方法是Paal-Knorr反應(yīng), Paal-Knorr反應(yīng)是利用1, 4-二羰基化合物與含硫化合物縮合生成噻吩及其衍生物[2].此外, 化學(xué)工作者也在探索以其它化合物為原料的噻吩及其衍生物的合成方法[3], 經(jīng)探索發(fā)現(xiàn)1, 3-丁二炔衍生物作為一種重要的合成中間體, 可以用于各種環(huán)狀化合物的合成[4], 而且使用1, 3-丁二炔及其衍生物作為原料時, 反應(yīng)具有原子經(jīng)濟性、原料簡單易得等特點.因而, 近來有一批文獻報道了一些以1, 3-丁二炔衍生物為原料的合成噻吩及其衍生物的新方法[5].例如Hua等[5a]報道了鈀催化或者直接采用氫氧化鉀促進炔烴與Na2S反應(yīng), 高產(chǎn)率地合成對稱的2, 5-二取代噻吩的方法. Zhang等[5b]報道了堿促進的中間體S3自由基參與的1, 3-丁二炔及其衍生物環(huán)化生成2, 5-二取代噻吩的合成方法, 該方法操作簡單, 產(chǎn)物易分離. Zhao等[5c]報道了NaHS可以在無金屬催化劑存在的條件下與1, 3-丁二炔反應(yīng)高產(chǎn)率地生成2, 5-二取代噻吩.盡管利用上述方法已經(jīng)可以有效合成噻吩類化合物, 但鑒于噻吩化合物在實際應(yīng)用中的重要性, 我們認為發(fā)展從簡單易得原料出發(fā), 更加簡單高效、綠色合成取代噻吩雜環(huán)的合成方法仍然很有必要.因此, 本課題組將報道一個綠色的, 高效地合成2, 5-二取代噻吩的新方法(Scheme 1), 并將對合成出噻吩衍生物進行初步的光學(xué)性質(zhì)研究.
 圖式1? 2, 5-二芳基噻吩的合成設(shè)計 圖式1.? Design for syntheses of 2, 5-diarylthiophene
圖式1? 2, 5-二芳基噻吩的合成設(shè)計 圖式1.? Design for syntheses of 2, 5-diarylthiophene
1?? 結(jié)果與討論
1.1?? 最佳反應(yīng)條件的建立
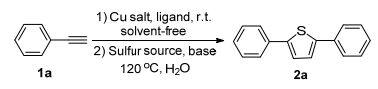
我們采用苯乙炔作為反應(yīng)原料經(jīng)過偶聯(lián)、環(huán)化等反應(yīng)串聯(lián)合成了2, 5-二苯基噻吩.實驗過程中首先以空氣為氧化劑, 以銅化合物為催化劑, 在室溫?zé)o溶劑的條件下, 苯乙炔經(jīng)過24 h氧化偶聯(lián)得到1, 3-二炔類化合物; 然后不經(jīng)分離, 在反應(yīng)混合物中加入水為溶劑, 以TEBA為相轉(zhuǎn)移催化劑, 以硫代有機物、NaHS為硫源, 在Ar保護堿性條件下, 于120 ℃經(jīng)過一定時間的反應(yīng), 環(huán)化生成2, 5-二取代噻吩化合物.探索了合成2, 5-二取代噻吩的反應(yīng)條件.實驗結(jié)果見表 1.
 |
|||||
| Entry | Catalyst | Ligand | Base | Reaction time/h | Yieldb/% |
| 1 | CuCl2 | TMEDA | KOH | 24, 24 | 71.0 |
| 2 | CuI | TMEDA | KOH | 24, 24 | 46.6 |
| 3 | CuCl | TMEDA | KOH | 24, 24 | 29.0 |
| 4 | Cu2O | TMEDA | KOH | 24, 24 | 22.4 |
| 5 | Cu(acac)2 | TMEDA | KOH | 24, 24 | 13.8 |
| 6 | CuCl2 | TEA | KOH | 24, 24 | 53.9 |
| 7 | CuCl2 | Oxine | KOH | 24, 24 | 48.4 |
| 8 | CuCl2 | 1, 10-Phenanthroline | KOH | 24, 24 | 46.2 |
| 9 | CuCl2 | Methenamine | KOH | 24, 24 | 45.4 |
| 10 | CuCl2 | TMEDA | NaOH | 24, 24 | 49.9 |
| 11 | CuCl2 | TMEDA | NaOAc | 24, 24 | 34.0 |
| 12 | CuCl2 | TMEDA | K2CO3 | 24, 24 | 47.7 |
| 13c | CuCl2 | TMEDA | KOH | 24, 24 | 76.1 |
| 14d | CuCl2 | TMEDA | KOH | 24, 24 | 45.0 |
| 15c | CuCl2 | TMEDA | KOH | 24, 36 | 89.3 |
| a General reaction conditions: phenylacetylene (2 mmol), Cu compounds (1 mol%), ligand (5 mol%), room temperature; base (2.0 mmol, cyclic reaction), H2O (1.0 mL, cyclic reaction), TAA (1.5 mmol, cyclic reaction), under Ar (cyclic reaction), TEBA (5 mol%, cyclic reaction), 120 ℃ (cyclic reaction). b Isolated yield. c 1.5 mmol of thiourea was used in place of TAA.d 1.5 mmol of NaHS was used in place of TAA. | |||||
從表 1中的數(shù)據(jù)可以看出, 二氯化銅的催化效果優(yōu)于其它銅鹽(表 1, Entries 1~5).隨后, 我們以二氯化銅為催化劑, 考察了各種配體對反應(yīng)的影響.實驗結(jié)果顯示以TMEDA為輔助配體時, 反應(yīng)收率最高, 達71.0% (表 1, Entries 1, 6~9).接著, 考察了各種堿對反應(yīng)的影響.在被考察的堿中, KOH得到了最高的收率, 而其它堿雖有一定效果, 但與KOH相比, 結(jié)果都不太理想(表 1, Entries 1, 10~12), 因此, 在后續(xù)反應(yīng)中, 我們均以KOH作為堿來考察其它因素對反應(yīng)的影響.考察不同硫源對反應(yīng)的影響結(jié)果顯示, 相對于硫代乙酰胺, 硫尿作為硫源時, 反應(yīng)收率更高, 達到76.1%(表 1, Entry 13);而使用NaHS作為硫源時, 反應(yīng)收率只有45% (表 1, Entry 14).最后考察了時間對該反應(yīng)的影響, 嘗試延長環(huán)化反應(yīng)時間到36 h, 產(chǎn)率升高到89.3%(表 1, Entry 15).
1.2?? 2, 5-二苯基噻吩衍生物的合成
在得到了合成2, 5-二苯基噻吩的最佳反應(yīng)條件之后, 我們進一步探索了不同芳基端炔在該反應(yīng)條件下的反應(yīng)活性, 實驗結(jié)果見表 2.
 |
從表 2中的數(shù)據(jù)可以看出, 在該反應(yīng)條件下, 以各種芳基端炔為原料的反應(yīng)均可以高效地合成2, 5-二取代噻吩, 實驗結(jié)果也顯示, 當(dāng)苯環(huán)對位上有強供電子基團時, 反應(yīng)的收率有所降低(表 2, Entries 3, 5);當(dāng)苯環(huán)的鄰、對位上有弱供電子基時, 反應(yīng)的收率變化不大(表 2, Entries 1, 2, 4, 7);當(dāng)苯環(huán)被吡啶環(huán)取代時, 反應(yīng)的收率變化也不大(表 2, Entry 8).實驗結(jié)果還顯示苯環(huán)間位上的氨基對反應(yīng)也沒有明顯的影響(表 2, Entry 6).
1.3?? 可能的反應(yīng)機理
根據(jù)文獻[5b, 6], 我們認為該合成過程是由兩步串聯(lián)而成, 第一步是端炔在銅催化下氧化偶聯(lián)生成1, 3-丁二炔, 第二步是硫尿在堿作用下形成S-離子, S-離子通過兩次加成-環(huán)化生成2, 5-二取代噻吩.具體的反應(yīng)機理見Scheme 2.
 圖式2? 可能的反應(yīng)機理 圖式2.? Possible reaction mechanism
圖式2? 可能的反應(yīng)機理 圖式2.? Possible reaction mechanism
1.4?? 2, 5-二苯基噻吩類化合物的光學(xué)性質(zhì)
1.4.1?? 2, 5-二苯基噻吩類化合物的紫外光譜
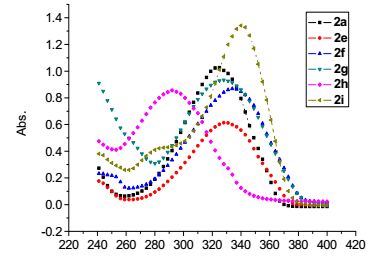
從上述合成出的8種2, 5-二取代噻吩化合物中選擇化合物2a, 2e~2i為代表, 研究了2, 5-二取代噻吩化合物的紫外光譜. 圖 1為所選擇的化合物在CH3OH (1×10-5 mol/L)中的紫外-可見吸收光譜(UV-Vis).
 圖?1? 化合物2a和2e~2i在甲醇中紫外吸收譜圖(1×10-5 mol/L) Figure?1.? UV-Vis spectra of compounds 2a and 2e~2i in methanol (1×10-5 mol/L)
圖?1? 化合物2a和2e~2i在甲醇中紫外吸收譜圖(1×10-5 mol/L) Figure?1.? UV-Vis spectra of compounds 2a and 2e~2i in methanol (1×10-5 mol/L)
如圖 1所示, 所選擇的化合物2a, 2e, 2f, 2g, 2h和2i的紫外最大吸收波長位于292~341 nm之間, 這一范圍的吸收是由共軛體系中噻吩環(huán)和芳環(huán)共軛的π-π*躍遷引起的, 由于芳環(huán)的不同, 或由于苯環(huán)上取代基的不同, 導(dǎo)致了所選擇的化合物2a, 2e~2i的紫外最大吸收波長在292~341 nm之間波動. 2a的最大紫外吸收波長為324 nm, 2e相對2a來說, 苯基的4-位上有甲基取代基, 甲基與苯環(huán)上的π66鍵存在著超共軛效應(yīng), 2e的最大紫外吸收波長小幅向長波方向移動, 為329 nm. 2f相對于2a來說, 苯基的4-位上有甲氧基取代基, 甲氧基中的氧上的p電子對與苯環(huán)上的π66鍵存在著共軛效應(yīng), 2f的最大紫外吸收波長向長波方向移動, 為334 nm. 2g相對于2a來說, 苯基的3-位上有氨基取代基, 氨基中的氮上的p電子對與苯環(huán)上的π66鍵存在著共軛效應(yīng), 2g的最大紫外吸收波長向長波方向移動, 為329 nm. 2h相對2a來說, 苯基的2-位上有甲基取代基, 由于甲基的體積位阻較大, 導(dǎo)致了苯環(huán)與噻吩環(huán)不能很好地共平面, 破壞了苯環(huán)與噻吩環(huán)的共軛效應(yīng), 2e的最大紫外吸收波長向短波方向移動, 為292 nm. 2i相對于2a來說, 苯環(huán)被置換成了吡啶環(huán), 2i的最大紫外吸收波長為341 nm.
1.4.2?? 2, 5-二苯基噻吩類化合物的熒光光譜
用甲醇、二氯甲烷分別作溶劑將2a, 2e~2i配成5×10-6 mol/L的濃度, 測得紫外吸收光譜, 分別得到相應(yīng)的最大吸收波長和它對應(yīng)的吸光度值A, 再用最大吸收波長作為激發(fā)波長, 測定它們的發(fā)射光譜λEM1, 再以λEM1最大值測定激發(fā)光譜λEX, 最后再以λEX最大值測定目標產(chǎn)物的熒光發(fā)射光譜λEM2, 測定結(jié)果如圖 2和圖 3所示. 圖 2為上述化合物在甲醇中的熒光發(fā)射光譜, 從圖 2中可以看出, 上述化合物的最大發(fā)射波長在386~454.5 nm之間, 化合物2e, 2f, 2g和2i的最大熒光發(fā)射波長相比2a的最大發(fā)射波長發(fā)生了紅移, 尤其是2g的紅移(67 nm)最為明顯, 這可能是取代基使共軛體系增大的緣故; 2h的最大熒光發(fā)射波長相比2a的最大發(fā)射波長, 發(fā)生了藍移, 這可能是由于甲基在苯環(huán)的2位時, 位阻破壞了苯環(huán)與噻吩環(huán)的有效共軛. 圖 3為上述化合物在二氯甲烷中的熒光發(fā)射光譜, 從圖 3中可以看出, 上述化合物的最大發(fā)射波長在390~412 nm之間, 化合物2e, 2f, 2g和2i的最大熒光發(fā)射波長相比2a的最大發(fā)射波長發(fā)生了紅移, 這可能是取代基使共軛體系增大的緣故; 2h的最大熒光發(fā)射波長相比2a的最大發(fā)射波長發(fā)生了藍移, 這可能是由于2位上的甲基的位阻使苯環(huán)與噻吩環(huán)不能有效共軛.從實驗結(jié)果可以發(fā)現(xiàn), 上述化合物在甲醇中熒光強度要強一些, 當(dāng)苯環(huán)3位上取代基是氨基時, 化合物的最大熒光發(fā)射波長在甲醇中的紅移明顯, 在二氯甲烷中只有輕微的紅移.
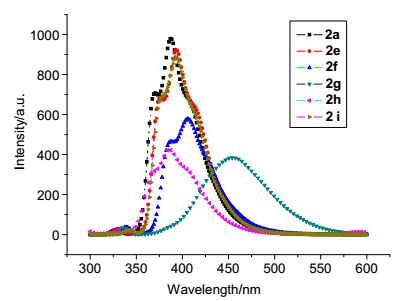 圖?2? 化合物2a和2e~2i在甲醇中的熒光光譜(5×10-6 mol/L) Figure?2.? Fluorescence spectra of compounds 2a and 2e~2i in methanol (5×10-6 mol/L)
圖?2? 化合物2a和2e~2i在甲醇中的熒光光譜(5×10-6 mol/L) Figure?2.? Fluorescence spectra of compounds 2a and 2e~2i in methanol (5×10-6 mol/L)
 圖?3? 化合物2a和2e~2i在二氯甲烷中的熒光光譜(5×10-6 mol/L) Figure?3.? Fluorescence spectra of compounds 2a and 2e~2i in dichloromethane (5×10-6 mol/L)
圖?3? 化合物2a和2e~2i在二氯甲烷中的熒光光譜(5×10-6 mol/L) Figure?3.? Fluorescence spectra of compounds 2a and 2e~2i in dichloromethane (5×10-6 mol/L)
2?? 結(jié)論
本文以芳基乙炔與硫脲為起始原料, 通過一鍋法, 經(jīng)過氧化偶聯(lián)反應(yīng)和成環(huán)反應(yīng)兩步串聯(lián), 合成了2, 5-二苯基噻吩及其衍生物.在此基礎(chǔ)上, 進一步探索了所合成化合物的UV和熒光性質(zhì), 實驗結(jié)果表明所合成化合物在甲醇中的紫外最大吸收波長在292~341 nm之間, 熒光光譜表明該類化合物具有良好的熒光性, 其在甲醇中最大發(fā)射波長在386~454.5 nm之間, 在二氯甲烷中測定的最大發(fā)射波長在390~412 nm之間.
3?? 實驗部分
3.1?? 儀器與試劑
高分辨質(zhì)譜測試: AB SCIEX Triple 5600+型液質(zhì)連用儀(美國AB SCIEX公司). 1H NMR和13H NMR譜: Mercury Plus 400型核磁共振儀(美國Varian公司), CDCl3為溶劑, TMS為內(nèi)標.紫外吸收光譜: Lambda 950紫外可見分光光度計上測定, 測試溶液樣品使用的樣品池是通光長度為1.0 cm的兩面通光的石英池.熒光光譜測試:帶恒溫系統(tǒng)的LS-50B型熒光光度計(美國Perkin-Elmer公司)測定, 測試溶液樣品使用的樣品池為1.0 cm×1.0 cm四面通光的石英比色皿.
所用的化學(xué)原料試劑全部從Alfa、Aldrich、百靈威等公司購買, 沒有進一步的純化; 常用溶劑購自國藥集團; 薄層層析硅膠由硅膠GF254 (青島海洋化工廠)和羧甲基纖維素(CMC)自制; 柱層析用硅膠為化學(xué)純試劑(青島海洋化工廠).
3.2?? 實驗方法
3.2.1?? 2, 5-二取代噻吩的合成
往反應(yīng)管中依次加入攪拌磁子、末端炔(2 mmol)、CuCl2 (5 mol%)和四甲基乙二胺(TMEDA) (5 mol%), 反應(yīng)在室溫攪拌反應(yīng)24 h; 然后加入2 mL純水、硫尿(1.5 mmol), TEBA (5 mmol%)和KOH (2 mmol), 升溫至120 ℃下攪拌反應(yīng)36 h至薄層色譜監(jiān)測原料完全轉(zhuǎn)化, 直接中性氧化鋁拌樣經(jīng)柱層析純化, 使用V(石油醚):V(二氯甲烷)=15:1作為淋洗劑, 得到產(chǎn)物2.
2, 5-二苯基噻吩(2a)[7]: 211 mg, 白色固體, m.p. 150~152 ℃ (lit.[7] 153 ℃); 1H NMR (CDCl3, 400 MHz) δ: 7.26~7.30 (m, 4H, ArH), 7.39 (t, J=8.0Hz, 4H, PhH), 7.64 (d, J=7.6 Hz, 4H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 143.6, 134.3, 128.9, 127.5, 125.7, 124.0; HRMS (ESI) calcd for C16H13S [M+H]+ 237.0738, found 237.0733.
2, 5-二(4′-乙基苯基)噻吩(2b): 211 mg, 淡黃色固體, m.p. 170~172 ℃; 1H NMR (CDCl3, 400 MHz) δ: 1.25 (t, J=7.6 Hz, 6H, CH3), 2.66 (q, J=7.6 Hz, 4H, CH2), 7.20 (s, 2H, ArH), 7.23 (t, J=7.6 Hz, 4H, PhH), 7.54 (d, J=8.0 Hz, 4H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 143.7, 143.3, 131.9, 128.4, 125.6, 123.5, 28.6, 15.6; HRMS (ESI) calcd for C20H21S [M+H]+ 293.1364, found 293.1358.
2, 5-二(4′-丁基苯基)噻吩(2c): 245 mg, 淡黃色固體, m.p.130~131℃ (lit.[5c] 132~134 ℃); 1H NMR (CDCl3, 400 MHz) δ: 0.93 (t, J=7.6Hz, 6H, CH3), 1.34~1.38 (m, 4H, CH2), 1.59~1.63 (m, 4H, CH2), 2.63 (q, J=7.6 Hz, 4H, CH2), 7.19 (d, J=8.0 Hz, 4H, PhH), 7.23 (s, 2H, ArH), 7.53 (d, J=8.4 Hz, 4H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 13.98, 22.37, 33.56, 35.37, 123.43, 125.51, 128.95, 131.87, 142.37, 143.29; HRMS (ESI) calcd for C24H29S[M+H]+ 349.1990, found 349.2011.
2, 5-二(4′-乙氧基苯基)噻吩(2d): 176 mg, 白色固體, m.p. 216~218 ℃; 1H NMR (CDCl3, 400 MHz) δ: 1.43 (t, J=7.2 Hz, 6H, CH3), 4.06 (q, J=7.2 Hz, 4H, CH2), 6.91 (d, J=8.8 Hz, 4H, PhH), 7.14 (s, 2H, ArH), 7.53 (d, J=8.8 Hz, 4H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 14.9, 63.6, 114.9, 122.8, 126.8, 127.2, 142.6, 158.6; HRMS (ESI) calcd for C20H21O2S[M+H]+ 325.1262, found 325.1254.
2, 5-二(4′-甲基苯基)噻吩(2e)[4p]: 227 mg, 白色固體, m.p. 157~159 ℃ (lit.[8] 161~164 ℃); 1H NMR(CDCl3, 400 MHz) δ: 2.37(s, 6H, CH3), 7.19 (d, J=7.6 Hz, 4H, PhH), 7.23 (s, 2H, ArH), 7.52 (d, J=8.0 Hz, 4H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 21.2, 123.4, 125.5, 129.6, 131.7, 137.3, 143.3; HRMS (ESI) calcd for C18H17S[M+H]+ 265.1051, found 265.1049.
2, 5-二(4′-甲氧基苯基)噻吩(2f)[5c]: 164 mg, 白色固體, m.p. 192~194 ℃ (lit.[5c] 216~217 ℃); 1H NMR (CDCl3, 400 MHz) δ: 3.84 (s, 6H, CH3), 6.92 (d, J=8.8 Hz, 4H, PhH), 7.25 (s, 2H, ArH), 7.54 (d, J=8.4 Hz, 4H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 55.39, 114.31, 122.90, 126.84, 134.06, 142.60, 159.12; HRMS (ESI) calcd for C18H17O2S[M+H]+ 297.0949, found 297.0947.
2, 5-二(3′-氨基苯基)噻吩(2g)[7]: 198 mg, 白色固體, m.p. 202~204 ℃ (lit.[7] 202 ℃); 1H NMR (CDCl3, 400 MHz) δ: 3.72 (s, 4H, NH2), 6.60~6.62 (m, 2H, PhH), 6.94 (m, 2H, PhH), 7.02~7.05 (m, 2H, PhH), 7.14~7.18 (m, 2H, ArH), 7.22(s, 2H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 112.2, 114.4, 116.2, 123.8, 129.6, 135.7, 143.6, 146.6; HRMS (ESI) calcd for C16H15N2S[M+H]+ 267.0956, found 267.0953.
2, 5-二(2′-甲基苯基)噻吩(2h)[7]: 190 mg, 無色液體. 1H NMR (CDCl3, 400 MHz) δ: 2.50 (s, 6H, CH3), 7.06 (s, 2H, ArH), 7.24~7.28 (m, 6H, PhH), 7.47 (m, 2H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 21.3, 126.0, 126.5, 127.8, 130.3, 130.7, 134.1, 136.0, 142.9; HRMS (ESI) calcd for C18H17S [M+H]+ 265.1051, found 265.1047.
2, 5-二(2′-吡啶基)噻吩(2i)[5c]: 167 mg, 淡黃色固體, m.p. 154~157 ℃ (lit.[5c] 157~159 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.16~7.20 (m, 2H, ArH), 7.65~7.75 (m, 6H, PhH), 8.60 (d, J=4.8 Hz, 2H, PhH); 13C NMR (CDCl3, 100 MHz) δ: 112.2, 114.4, 116.2, 123.8, 129.6, 135.4, 146.6. HRMS (ESI) calcd for C14H11N2S [M+H]+ 239.0643, found 239.0641.
????????????????????????????????????????????????????????????? 化學(xué)慧定制合成事業(yè)部摘錄







