 圖式1? 銅催化機理 Scheme1.? Copper-catalyzed mechanism
圖式1? 銅催化機理 Scheme1.? Copper-catalyzed mechanism 2012年Bantreil等[4]用氧化銅作催化劑, 叔丁基過氧化氫 (TBHP) 作氧化劑, 醇和胺的鹽酸鹽在80 ℃下反應4 h, 得到酰胺 (Eq. 1).該反應中會產生副產物酸, 加入過量的醇可避免因副產物的生成而減少酰胺的產率, 且副產物酸在后處理時容易除去.含手性原料參與反應, 生成酰胺的選擇性也相當好.
反應機理如Scheme 1: A分子內β-氫脫掉生成苯甲醛和叔丁醇同時生成有活性的二價銅, 生成的苯甲醛和銅離子絡合物和自由胺、碳酸鈣反應生成中間體B, 在過氧化物的存在下B進化成C, 接著β-氫離去生成酰胺 D, 并且再次生成二價銅催化劑.實驗表明第一次催化循環即氧化成醛是比第二次催化循環即醛的酰胺化要慢.
 圖式1? 銅催化機理 Scheme1.? Copper-catalyzed mechanism
圖式1? 銅催化機理 Scheme1.? Copper-catalyzed mechanism
2013年Ghosh小組[5]提出用硝酸鐵作催化劑, 在空氣中合成酰胺的方法 (Scheme 2).該反應分兩步進行, 首先鐵鹽和2, 2, 6, 6-四甲基哌啶-氮-氧化物 (TEMPO) 聯合作催化劑, 空氣中的氧作為氧化劑, 氧化醇到醛; 第二步醛和胺的鹽酸鹽在叔丁基過氧化氫 (TBHP) 作氧化劑, 碳酸鈣作堿的條件下反應得到酰胺.用純氧作氧化劑存在一定的安全隱患, 改用大氣中的氧氣, 對反應亦沒有影響.但同時出現新的問題, 由于是開放系統, 反應液中的溶劑處在暴露中, 就會不斷向大氣中揮發, 對環境和人身都會造成一定傷害, 急需改善.
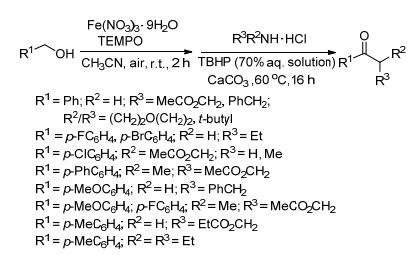 圖式2? 鐵催化生成酰胺 Scheme2.? Amide formation by iron catalysts
圖式2? 鐵催化生成酰胺 Scheme2.? Amide formation by iron catalysts
機理如Scheme 3: Fe-TEMPO介導氧化醇生成醛, 然后和胺在原位發生反應形成半縮醛中間體, 進一步通過游離基機理被Fe-TBHP催化氧化.
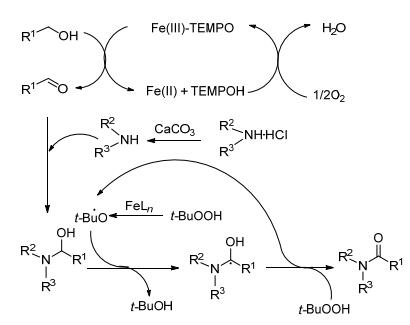 圖式3? (Fe-TEMPO) 催化氧化氨化機理 Scheme3.? A mechanism for (Fe-TEMPO)-catalysed tandem oxidative amidation
圖式3? (Fe-TEMPO) 催化氧化氨化機理 Scheme3.? A mechanism for (Fe-TEMPO)-catalysed tandem oxidative amidation
2014年Islam等[6]提出用聚合物錨定二價釕作為制備二級酰胺的催化劑 (Eq. 2).醇和胺在該催化劑作用下, 碳酸銫作堿, 3-甲基-2-丁酮作氫的接受體, 正丁醇作溶劑回流18 h得到酰胺.醇中甲氧基的引入會使得反應收率明顯提高 (87%~96%), 且幾乎沒有副產物.催化劑可以重復使用六次而不失活性, 在工業上的應用有著光明的前景. Hong等[7]報道N雜環卡賓釕配合物被用于催化醇和胺在無堿的條件下合成酰胺, 反應受所帶基團的電子效應的影響明顯.反應條件對于仲胺參與反應不是很適用, 需要加入催化量的堿, 促進醇和胺的反應.
2015年Rokade等[8]提出用高氯酸銅作催化劑, 催化氧化α, β-不飽和烯醇和疊氮三甲基硅烷 (TMSN3) 反應生成α, β-不飽和酰胺 (Eq. 3).疊氮三甲基硅烷作為氮的來源, 2, 3-二氯-5, 6-二氰基-1, 4-苯醌 (DDQ) 作氧化劑, 醋酸和水作溶劑, 在室溫下和醇反應1 h得到酰胺.該工藝是專門為α, β-不飽和烯醇向不飽和酰胺轉化所設計, 收率很好.但反應中使用的TMSN3是有毒的危險品, 對環境和人身都有危害, 不適宜在放大工藝中使用.
2016年, Hull等[9]用金屬銠作催化劑, 醇和胺一鍋法得到酰胺.同年Hong等[10]提出一種高效、無金屬催化的直接由醇合成酰胺的方法 (Eq. 4).偶氮化合物作為氮的來源和醇反應, 叔丁基過氧化氫作氧化劑, 乙腈作溶劑, 在120 ℃下反應24 h得到相應的酰胺, 電子效應對該反應并沒有明顯的影響.苯系醇和脂肪族甚至萘系醇參與反應都有不錯的收率.
反應機理如Scheme 4:苯甲醇先被過氧化物氧化成醛, 再轉變成自由基, 偶氮苯和自由基反應生成中間體, 再吸引叔丁基過氧化氫上的氫原子得到另一中間體, 最后水解得到酰胺.
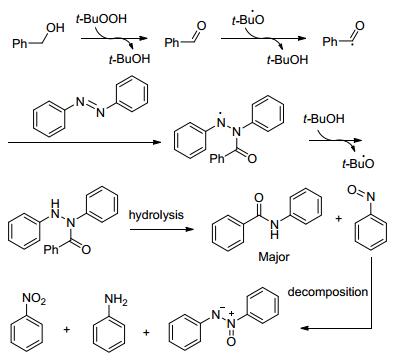 圖式4? 反應機理 Scheme4.? Proposed mechanism
圖式4? 反應機理 Scheme4.? Proposed mechanism 






