 圖式12? 銠催化硼酸和NCTS氰基化反應合成氰 圖式12.? Rhodium catalyzed cyanation of boronic acids with NCTS for the synthesis of nitriles
圖式12? 銠催化硼酸和NCTS氰基化反應合成氰 圖式12.? Rhodium catalyzed cyanation of boronic acids with NCTS for the synthesis of nitriles ???? 氰胺類化合物作為一類重要的親電氰基化試劑, 已被廣泛應用于合成具有高應用價值的氰基化合物.常見的親電氰基化試劑有1-氰基苯并三唑[42]、1-氰基咪唑[43]、N-氰基丁二酰亞胺、1-氰基苯并咪唑[44]、N-氰基-N-苯基對甲苯磺酰胺(NCTS)[45]和二烷基氰胺[46]等, 其中N-氰基-N-苯基對甲苯磺酰胺(NCTS)具有毒性低、穩定和實用等優點, 近年來對其反應活性的研究異常活躍.
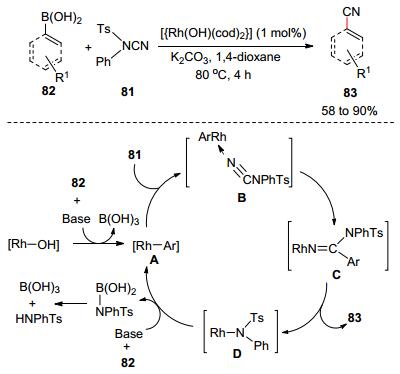
2011年, Beller和Anbarasan等[45a]以NCTS (81)為氰基化試劑, 發展了[{Rh(OH)(cod)2}]催化硼酸82的氰基化反應合成氰類化合物83 (Scheme 12).相較于金屬氰化物的親核氰基化反應, 該反應避免了使用劇毒試劑; 但反應中往往產生N-苯胺對苯磺酰胺副產物, 反應的原子經濟性低下.結合已報道的銠催化芳基硼酸和不飽和鍵的加成反應機理, 作者推斷以下反應過程:芳基硼酸和銠發生金屬轉移生成芳基銠A, A接著和NCTS配位產生絡合物B.然后, B進行分子內的芳基轉移產生芳基脒絡合物C.最后, C發生還原消除生成芳基氰和氨基銠化物D, D在堿性條件和芳基硼酸反應再生成銠活性催化劑形成催化循環.同年, 他們又將NCTS應用至和格氏試劑的親電氰基化反應中合成各種芳基氰, 反應中格氏試劑通過鎂試劑和芳基溴化物的反應原位生成[45b]. 4年后, Gosmini等[45c]報道了CoBr2/Zn促進芳基溴和NCTS的氰基化反應.作者通過實驗證實, CoBr2首先催化芳基溴先和Zn反應生成芳基鋅試劑, 接著再催化芳基鋅試劑和NCTS進行交叉偶聯生成芳基氰.反應對酯基、烷硫基、氰基和酮羰基等活性官能團都有良好的兼容性.
 圖式12? 銠催化硼酸和NCTS氰基化反應合成氰 圖式12.? Rhodium catalyzed cyanation of boronic acids with NCTS for the synthesis of nitriles
圖式12? 銠催化硼酸和NCTS氰基化反應合成氰 圖式12.? Rhodium catalyzed cyanation of boronic acids with NCTS for the synthesis of nitriles
同樣是在2011年, Wang等[45d]以NCTS為氰基化試劑, 在BF3·Et2催化下分別和吲哚及吡咯84發生C—H活化/氰基化反應直接合成氰基化合物85 (Eq. 19).吲哚化合物的反應選擇性發生3-位上, 而吡咯的反應則主要發生在2-位上.相較于官能化芳烴的反應, 本方法直接使用簡單易得的芳雜烴類化合物為原料, 減少對芳烴的官能化操作, 且具有較高的原子經濟性.
2013年, Fu課題組[45e]將NCTS應用到芳烴(86)的導向氰基化反應中, 成功實現C—H活化直接合成芳基氰類化合物87 (Eq. 20).作者發現以肟醚、咪唑、吡啶和吡唑等作為導向基團, 在[RhCp*(CH3CN)3](SbF6)2的催化下都可以實現對導向基團鄰位C(sp2)—H的活化反應合成直接鄰位氰基化產物.該反應對官能團具有良好的兼容性, 羥基、碘、酯、烷硫基和環氧乙環等基團都能在反應中存活.幾乎在同一時間, Anbarasan和合作者同樣以NCTS為氰基化試劑, 發展了[Cp*RhCl2]2催化吡啶基導向的鄰位C(sp2)—H活化氰基化反應合成2-(2-吡啶基)苯甲氰類化合物[45f].這兩種C(sp2)—H活化氰基化反應的發現引起了合成化學家們對過渡金屬催化芳烴和NCTS的直接氰基化反應研究的熱潮.近四年來, 以NCTS為氰基化試劑, 銠催化不同基團導向的鄰位C(sp2)—H活化反應陸續被發現, 如芳基磷酸酯鄰位氰基化反應[45g]、N-酰基吲哚啉的7-氰基化反應、N-(2-嘧啶基)吲哚的2-氰基化反應[45h]、N-(2-吡啶基)吲哚的2-氰基化反應、N-(2-吡啶基)吡咯的2-氰基化反應[45i]和芳基咪唑并[1, 2-α]吡啶的雙氰基化反應[45j]等.
除了作為氰基化試劑, 氰胺還被廣泛用作氨基氰基化試劑, 和不飽鍵發生加成反應合成氰基取代的胺類化合物.
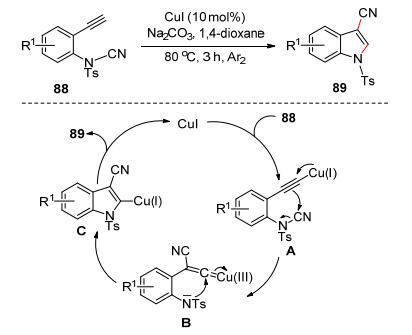
2016年Chien等[47]以銅為催化劑, 催化鄰炔基芳香氰胺88的分子內氨基氰基化反應高效合成3-氰基吲哚89 (Scheme 13).作者提出了以下反應機理:銅先和末端炔反應生成炔基銅A, 接著和氰胺基發生CN基轉移反應生成氰基亞烯基銅中間體B, 最后氨基和氰基亞烯基銅進行親核加成和質子化反應生成目標產物.
 圖式13? 銅催化鄰炔基芳香氰胺環化反應合成3-氰基吲哚 圖式13.? Copper-catalyzed cyclization of o-alkynyl arylcyanamides for the synthesis of 3-cyanoindoles
圖式13? 銅催化鄰炔基芳香氰胺環化反應合成3-氰基吲哚 圖式13.? Copper-catalyzed cyclization of o-alkynyl arylcyanamides for the synthesis of 3-cyanoindoles
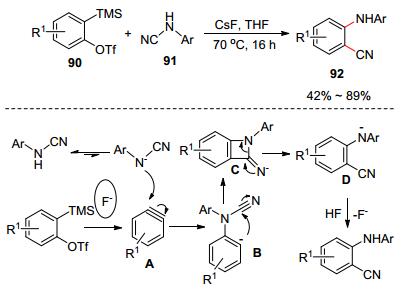
2014年Zeng課題組[48]報道了氰胺和苯炔前體的分子間氨基氰基化反應, 高效合成雙官能分子2-氨基苯甲氰類化合物.在CsF的促進下, 2-(三甲基硅基)苯酚三氟甲磺酸酯(90)和芳基氰胺(91)反應生成2-氨基苯甲氰類化合物92 (Scheme 14).作者對反應過程進行探索, 并提出了以下反應機理: 2-(三甲基硅基)苯酚三氟甲磺酸酯在CsF的作用下脫掉三甲基硅基和三氟甲磺酸基生成苯炔, 苯炔接著和氰胺進行加成及后續的重排和質子化反應產生2-氨基苯甲氰.
 圖式14? CsF促進2-(三甲基硅基)苯酚三氟甲磺酸酯和氰胺串聯反應合成2-氨基苯甲氰類化合物 圖式14.? CsF-promoted cascade reaction of cyanamides and (trimethylsilyl)aryl trifluoromethanesulfonate for the synthesis of 2-aminobenzonitriles
圖式14? CsF促進2-(三甲基硅基)苯酚三氟甲磺酸酯和氰胺串聯反應合成2-氨基苯甲氰類化合物 圖式14.? CsF-promoted cascade reaction of cyanamides and (trimethylsilyl)aryl trifluoromethanesulfonate for the synthesis of 2-aminobenzonitriles
除了和炔的氨基氰基化反應, 氰胺還可以和烯烴發生氨基氰基化反應, 這類反應已被廣泛應用于β-氰基胺類化合物的合成, 具有100%的原子經濟性.
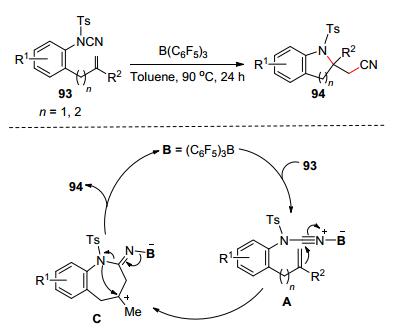
2014年Douglas等[49]報道了無金屬Lewis酸促進的分子內雙鍵氨基氰基化反應直接合成2-氰甲基吲哚啉(94) (Scheme 15).作者以[2-(N-對甲苯磺酰基)氰胺基苯基]烯烴(93)為原料, 在B(C6F5)3促進作用下, 實現對氰胺基C-CN的切斷并和雙鍵發生加成反應構建2-氰甲基吲哚啉.基于實驗結果, 作者提出了以下反應機理:氰胺和B(C6F5)3配位生成中間體A, A發生烯烴對氰基碳的親核進攻產生中間體C. C最后發生重排即可生成最終產物和促進劑B(C6F5)3.
 圖式15? B(C6F5)3促進分子內烯烴氨基氰基化反應合成吲哚啉 圖式15.? B(C6F5)3-promoted intramolecular aminocyanation of alkenes by cyanamides for the synthesis of indolines
圖式15? B(C6F5)3促進分子內烯烴氨基氰基化反應合成吲哚啉 圖式15.? B(C6F5)3-promoted intramolecular aminocyanation of alkenes by cyanamides for the synthesis of indolines
后來, Nakao和其合作者[50]又發展了鈀催化分子內烯烴氨基氰基化反應.他們以N-酰基氰胺(95)為原料, 在CpPd(allyl)和BR43的共同作用下發生烯烴氨基氰基化反應合成吲哚啉96 (Scheme 16).基于實驗結果, 作者對反應機理進行了推斷: N-酰基氰胺和硼烷進行配位生成A, A的氰氨基接著和[Pd0]發生氧化加成生成C. C進行exo–trig順式氨基鈀化反應產生D. D最后發生還原消除反應和硼烷轉移反應生成目標產物、[Pd0]催化劑和絡合物A形成催化循環.
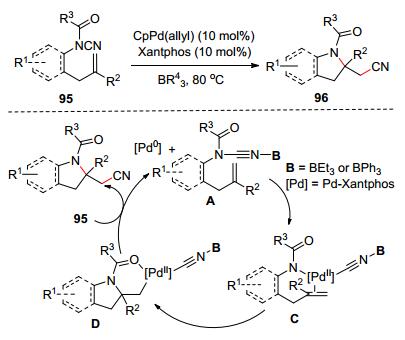 圖式16? 鈀催化分子內氨基氰基化反應合成吲哚啉 圖式16.? Palladium-catalyzed intramolecular aminocyanation of alkenes for the synthesis of indolines
圖式16? 鈀催化分子內氨基氰基化反應合成吲哚啉 圖式16.? Palladium-catalyzed intramolecular aminocyanation of alkenes for the synthesis of indolines
2013年Wang等[51]發展了銠催化芳基乙烯97的分子內β-氰基化反應, 合成2-(2-氨基芳基)烯氰類化合物98 (Eq. 21).作者發現在[RhCl(COD)]2]/DPEphos催化下, 鄰氰胺基芳基乙烯發生N—CN鍵斷裂并和雙鍵發生H和CN交換反應生成(2-氨基芳基)氰基乙烯類化合物.
????????????????????????????????????????????????????????????????? 化學慧定制合成事業部摘錄







