惡性腫瘤在經傳統療法治療后產生復發和轉移及其相應的并發癥是造成患者死亡的主要原因。理論上講,激發機體自身免疫是最為理想的抑制腫瘤轉移和復發的手段。北京大學的劉昭飛教授(點擊查看介紹)課題組利用一種基于氧化石墨烯的腫瘤靶向性納米材料,在小鼠體內有效激活機體的抗腫瘤免疫,從而抑制了腫瘤的轉移和復發。
經光動作用殺傷的腫瘤細胞會釋放損傷相關分子模式(damage associated molecular patterns, DAMPs),其中包含大量的腫瘤特異性抗原,經刺激抗原提呈細胞(如樹突狀細胞)成熟后能夠有效激活特異性針對腫瘤細胞的免疫細胞(如CD8陽性T細胞等)。在該研究中,作者基于氧化石墨烯納米材料,在其表面裝載光敏劑光克洛(HPPH)來產生光動治療作用,并通過連接腫瘤整合素αvβ6特異性的多肽,實現對腫瘤的體內特異性光動治療。研究發現,無論是使用該納米材料對原位腫瘤進行殺傷,或是將其殺死的腫瘤細胞制成“疫苗”接種,均能有效地抑制腫瘤的遠端轉移,從而證實了該方法可激活機體的抗腫瘤免疫效應及長效免疫記憶。
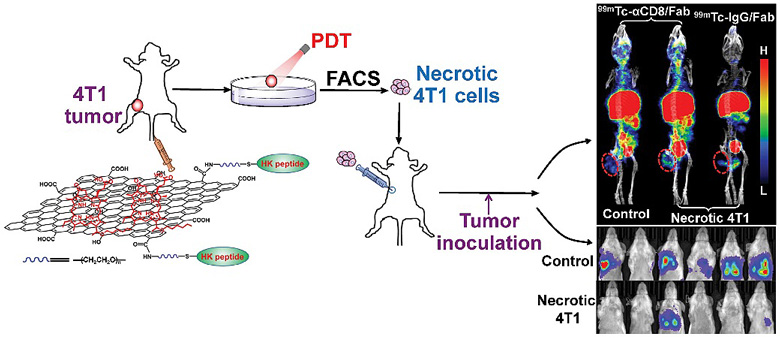
同時,該團隊還針對CD8陽性T細胞設計構建了放射性核素和光學染料標記的分子影像探針,通過在體單光子發射計算機斷層(SPECT)/CT和近紅外光學顯像,實現了對腫瘤靶向光動治療后原位和遠端腫瘤CD8陽性T細胞浸潤的可視化無創監測,從而在機制上證實了CD8陽性T細胞在腫瘤光動治療免疫效應中的關鍵作用。這一成果近期發表在ACS Nano 上,文章的共同第一作者是北京大學的博士研究生俞欣荷和碩士研究生高鐸。
化學慧納米材料系列產品







