引言
骨缺損導致患者運動障礙、功能缺失甚至危及生命。由于自體骨的來源有限,異體骨有排異性,骨修復與再生一直是醫學難題。以干細胞、支架材料和生長因子為主要構成元素的組織工程方法是這一難題的最有前途的解決方式。其中,調控干細胞向成骨細胞分化,是實現新骨形成、骨組織重建的關鍵。利用特殊蛋白對干細胞分化進行調控的方法,因蛋白價格來源少、價格高、容易失活,且調控耗周期長,難以實用化。近年來發現利用材料表面納米結構可以實現可靠、快速、持久且位置可控的干細胞分化的精準調控,這種干細胞的物理調控方法為骨修復提供了重要的途徑。然而,目前為止,很少有人利用生物可降解材料構建納米結構,實現納米結構調控的干細胞成骨分化和骨組織修復過程。
成果簡介
近日,山東大學劉宏、劉鐸和山東大學齊魯醫院劉超(共同通訊)等人利用市售的不同型號的多孔陽極氧化鋁(AAO)作為模板,采用簡便易行的微壓印的方法在聚乳酸(PLA)薄膜表面構建了不同直徑的納米柱陣列。通過對人的脂肪來源間充質干細胞(hADSCs)在PLA納米柱陣列上的分化行為的研究,發現在不使用任何化學或者生物誘導條件下,hADSCs在不同直徑的納米柱表面結構上表現出完全不同的分化能力。研究發現,直徑為200 nm的納米柱陣列最能促進脂肪間充質干細胞向成骨分化,動物實驗也證實了這種PLA納米柱陣列材料可以實現異位成骨。相關成果以題為“Polylactic Acid Nanopillar Array-Driven Osteogenic Differentiation of Human Adipose-Derived Stem Cells Determined by Pillar Diameter”發表在Nano Letters上。
圖文導讀
圖1 不同納米柱直徑聚乳酸陣列的形貌圖及其生物相容性測試

a-c) 聚乳酸平片的表面形貌;
d-f,g-h,j-l) 直徑分別為100 nm、200 nm和300 nm的AAO模板及其對應制備的PLA納米柱陣列形貌;m-x. hADSCs在不同納米柱直徑陣列上的活死細胞染色;
y-z) hADSCs在不同襯底上的鋪展示意圖及cck-8測試結果。
圖2 hADSCs在不同納米柱直徑聚乳酸陣列上的鋪展形貌
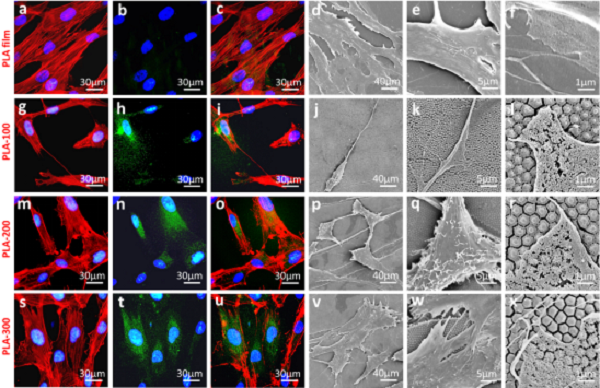
a-f)hADSCs在聚乳酸平片上的鋪展形貌;
g-l) hADSCs在納米柱直徑為100 nm襯底上的鋪展形貌;
m-r) hADSCs在納米柱直徑為200 nm襯底上的鋪展形貌;
s-x) hADSCs在納米柱直徑為300 nm襯底上的鋪展形貌。
圖3 hADSCs在不同納米柱直徑聚乳酸陣列上培養21天后成骨相關基因的q-PCR測試結果
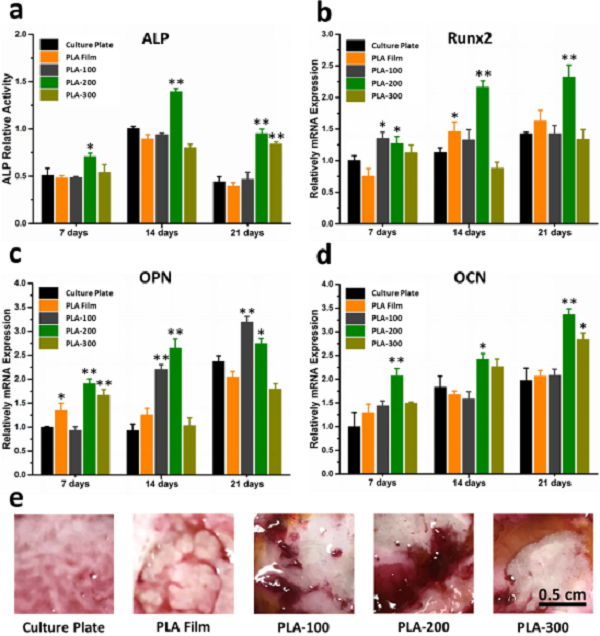
a)不同培養襯底上hADSCs的ALP蛋白含量;
b) 不同培養襯底上hADSCs的Runx2基因表達;
c)不同培養襯底上hADSCs的OPN基因表達;
d) 不同培養襯底上hADSCs的OCN基因表達;
e) 不同培養襯底上hADSCs的茜素紅染色結果。
圖4 hADSCs在不同納米柱直徑聚乳酸陣列上培養21天后成骨相關蛋白的熒光免疫染色結果
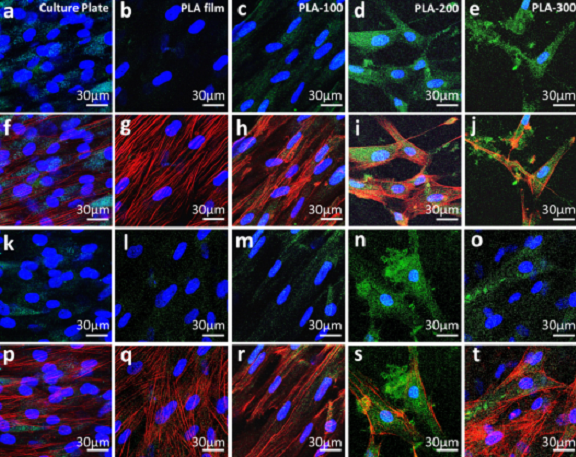
a-j) 不同培養襯底上hADSCs的OPN免疫熒光染色結果;
k-t) 不同培養襯底上hADSCs的OCN免疫熒光染色結果。
圖5 異位成骨組織切片的ALP免疫組織化學染色和H&E染色結果

a)PLA平片上異位成骨組織切片的ALP免疫組織化學染色結果;
b)納米柱直徑為200 nm的PLA納米柱陣列上異位成骨組織切片的ALP免疫組織化學染色結果;
c)PLA平片上異位成骨組織切片的H&E染色結果;
d)納米柱直徑為200 nm的PLA納米柱陣列上異位成骨組織切片的H&E染色結果。
小結
該研究指出,三種納米柱陣列材料(柱體直徑分別為100 nm,200 nm和300 nm)具有程度不同的成骨誘導能力,而PLA平片基本不具備成骨誘導能力。且僅在培養48 h后,不同襯底上hADSCs的形態就產生了很大差異,在聚乳酸平片及其他襯底上的干細胞仍呈梭形,而直徑為200 nm的PLA納米柱陣列材料上的細胞已呈現成骨細胞特征多邊形結構。培養21天后的基因和蛋白測試結果也表明直徑為200 nm的PLA納米柱陣列材料具有最強的成骨分化促進效果,且在異位成骨中也能富集更多與成骨相關的蛋白。因此,該研究利用生物可降解材料構建納米結構,推進了納米結構調控的干細胞成骨分化和骨組織修復過程。
化學慧納米材料系列產品







