 圖式7? 氰胺和吡啶N-氧多米諾反應合成脲類化合物 圖式7.? Domino reaction of cyanamides and pyridine N-oxides for the synthesis of ureas
圖式7? 氰胺和吡啶N-氧多米諾反應合成脲類化合物 圖式7.? Domino reaction of cyanamides and pyridine N-oxides for the synthesis of ureas 以氰胺為原料, 其和親核試劑的加成反應已被應用于合成在醫藥、農藥和材料等領域有廣泛應用價值的胍及其衍生物.
早期, 氰胺和親核試劑的加成反應主要應用于鏈狀胍、異脲、硫代異脲的合成, 這類反應具有100%的原子經濟性[22].后來, 合成化學家們將其推廣到環胍及其衍生物的合成中, 其中Looper課題組[23]做了系統的研究工作. 2009年, 他們結合親核加成和分子內的氫胺化反應, 發展了炔丙基氰胺36和胺37的串聯反應直接合成2-氨基咪唑38 (Eq. 8).在La(OTf)3催化下, 胺和炔丙基氰胺首先發生親核加成反應生成鏈狀胍, 鏈狀胍接著進行分子內炔氫氨化反應生成2-氨基咪唑. 2010年, 他們成功將反應拓展到2-硫基咪唑40和2-氧基咪唑42的合成[24].在堿促進作用下, 炔丙基氰胺即可以分別和硫醇39及醇41發生串聯反應生成2-硫基咪唑(Eq. 8) 和2-氧基咪唑(Eq. 10).
2015年Fu等[25]同樣基于氰胺的加成反應, 發展了銅催化氰胺43和鄰鹵代芳胺44的多米諾反應合成稠環胍45 (Eq. 11).氰胺首先和鄰鹵代芳烴發生C—N偶聯反應, 接著再進行分子內連續的親核加成和氫氨化反應即可實現對稠環胍的構建.
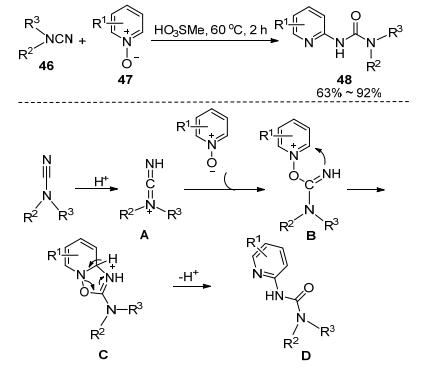
最近, Rassadin等[26]以氰胺46為原料, 發展了和吡啶N-氧47的無溶劑多米諾反應, 高效合成脲48 (Scheme 7).在甲磺酸的促進作用下, 氰胺和吡啶N-氧化物先發生親核加成, 接著進行一系列重排反應生成N-(2-吡啶基)脲.該反應的原子利用率為100%, 且可在無溶劑條件下進行, 是一種綠色環保的脲類化合物的合成方法.
 圖式7? 氰胺和吡啶N-氧多米諾反應合成脲類化合物 圖式7.? Domino reaction of cyanamides and pyridine N-oxides for the synthesis of ureas
圖式7? 氰胺和吡啶N-氧多米諾反應合成脲類化合物 圖式7.? Domino reaction of cyanamides and pyridine N-oxides for the synthesis of ureas
除了氰胺的親核加成反應, 近年來研究發現其自由基加成反應也可以實現, 并成功應用到多種胍類化合物的合成中.
2010年, Malacria和Lac?te等[27]證實N-酰基氰胺49在Bu3SnH/AIBN促進下引發自由基串聯反應高效合成稠環胍50 (Scheme 8).在Bu3SnH/AIBN促進下, 疊氮基先生成氨基自由基, 接著發生串聯的自由基加成和C—N偶聯反應產生稠環胍.
 圖式8? N-酰基氰胺自由基串聯反應合成稠環胍 圖式8.? Radical cascade reaction of N-acyl cyanamides for the synthesis of fused cyclic guanidines
圖式8? N-酰基氰胺自由基串聯反應合成稠環胍 圖式8.? Radical cascade reaction of N-acyl cyanamides for the synthesis of fused cyclic guanidines
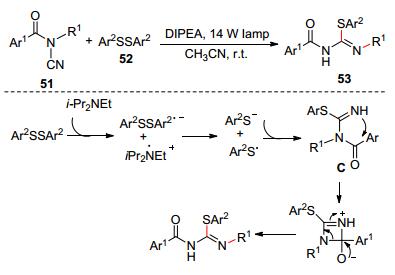
兩年后, Malacria和Lac?te等[28]又發現N-酰基氰胺51和芳香二硫52在Hünig堿和光照條件作用下可發生自由基串聯反應合成硫代異脲53 (Scheme 9).在光照條件下, 芳香二硫化合物和Hünig堿發生自由基反應生成硫醇自由基, 接著和氰基發生加成和后續的重排反應生成硫代異脲類化合物.此外, 基于該反應, 他們發展了N-酰基氰胺、二硫化合物和胺的一鍋煮三組分反應, 實現對胍類化合物的直接合成.
 圖式9? N-酰基氰胺和二硫化合物自由基串聯反應合成異脲類化合物 圖式9.? Radical cascade reaction of N-acyl cyanamides and diaryldisulfides for the synthesis of isothioureas.
圖式9? N-酰基氰胺和二硫化合物自由基串聯反應合成異脲類化合物 圖式9.? Radical cascade reaction of N-acyl cyanamides and diaryldisulfides for the synthesis of isothioureas.
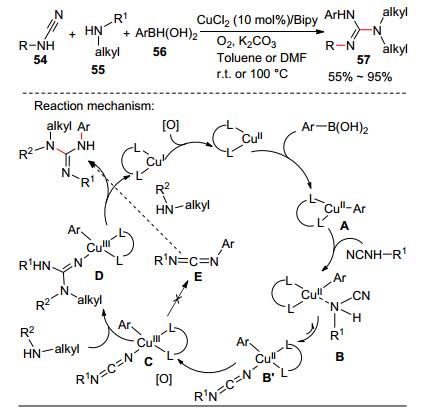
最近Neuville和Li等發展了銅催化氰胺54、脂肪胺55和硼酸56三組分反應高效合成N, N‘, N”-三取代胍57 (Scheme 10)[29].由于反應在氧氣氛圍下進行, 底物適用范圍有一定的局限性且對官能團兼容性差.作者對反應機理進行了深入研究, 提出了以下反應機理:硼酸先和銅發生金屬轉移反應生成中間體A. A接著和氰胺進行配位, 并在堿作用下發生去質子化和重排生成B’. B’進行氧化、親核加成和還原消除的串聯反應生成目標產物.后來, 基于該三組分反應, 他們通過利用不同的氰胺為原料, 實現一鍋煮反應直接合成2-氨基苯并咪唑和2-氨基喹啉[30].
 圖式10? 銅催化氰胺、胺和硼酸三組分反應合成胍 圖式10.? Copper-catalyzed three-component reaction of cyanamides, amines and boronic acides for the synthesis of guanidines
圖式10? 銅催化氰胺、胺和硼酸三組分反應合成胍 圖式10.? Copper-catalyzed three-component reaction of cyanamides, amines and boronic acides for the synthesis of guanidines
?? 由于上述銅催化氰胺、胺和硼酸三組分反應的氧化反應條件對底物和官能團的兼容性較差, 且一些硼酸原料的熱穩定差, 使得該反應的應用有一定的局限性.為了克服上述反應中存在缺點, 最近我們課題組以三氟甲磺酸二芳基碘鹽58為芳基化試劑, 發展了銅催化其和氰胺54及胺55三組分反應高效構建胍59 (Eq. 12)[31].相交于之前發展的銅催化硼酸的三組分反應[30], 本反應具有更廣泛的適用性.脂肪族和芳香族胺都能適應反應, 但芳香族胺的產率較低.雜環芳基碘鹽同樣也適用于本反應, 可用于合成芳雜環取代的胍類化合物.另外, 具有環張力的環丙基氰胺同樣以較好的產率生成相應環丙基胍.然而, 該反應中二芳基碘鹽僅有一個芳基參與反應, 反應原子經濟性低.
???????????????????????????????????????????????????????????????????????? 化學慧定制合成事業部摘錄







