二氧化鈦有三種礦物形式:銳鈦礦、金紅石和板鈦礦。 銳鈦礦相二氧化鈦的結構屬于四方晶系, 其中每個八面體與周圍 8 個八面體相連接( 4 個共邊, 4 個共頂角), 4 個 TiO2 分子組成一個晶胞(圖 ( b) ), 主要用于紫外光照射下的光催化劑。 由于高電子遷移率、低介電常數和低密度, 銳鈦礦二氧化鈦在太陽能電池應用中很受歡迎。 金紅石相二氧化鈦也是四方晶系, Ti 原子位于晶格中心, 6 個氧原子位于八面體的棱角上, 每個八面體與周圍 10 個八面體相連(其中有八個共頂角,兩個共邊),兩個 TiO2 分子組成一個晶胞( 圖 ( a) )。 金紅石相在大多數的溫度和壓力下都比較穩定。 作為催化劑來講,金紅石相二氧化鈦的活性是非常低的,所以其主要用作涂料中的白色顏料。 板鈦礦二氧化鈦屬于斜方晶系, 6 個 TiO2 分子組成一個晶胞。 因為板鈦礦相晶體結構很不穩定,所以在自然界中存在比較稀少。
三種晶相中金紅石相是最穩定的, 銳鈦礦相和板鈦礦相經過加熱處理后會發生不可逆的放熱反應, 最終轉變為金紅石相。
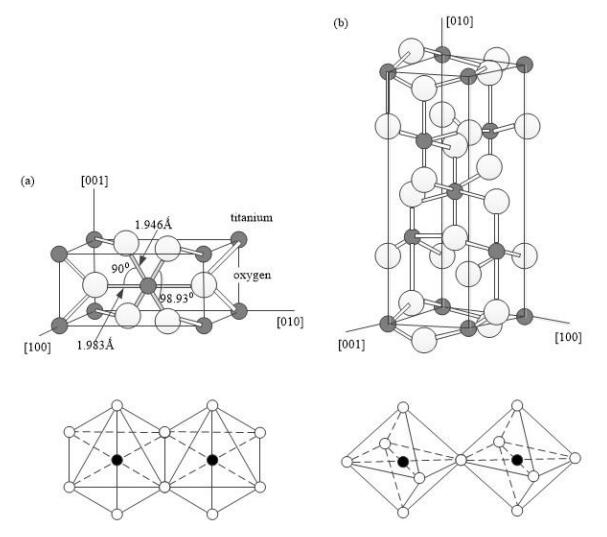
圖 1 ?TiO2 的晶體結構參數:( a)金紅石相,( b)銳鈦礦相
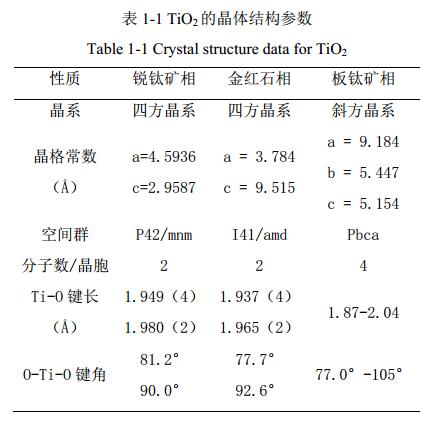
二氧化鈦是寬能帶半導體材料,其銳鈦礦相、金紅石相和板鈦礦相的禁帶寬度分別是 3.2 eV、 3.02 eV 和 2.96 eV。 TiO2 的價帶由 Ti 的 3d 軌道和與之雜化的 O 的 2p 軌道組成, 而導帶只有 Ti 的 3d 軌道。 當用波長小于等于 387 nm 的光照射 TiO2時,其價帶上的電子就會被激發進入到導帶,形成帶負電的高活性電子 e-,同時在價帶上形成帶正點的空穴 h+,即電子-空穴對, 如圖 2 所示。
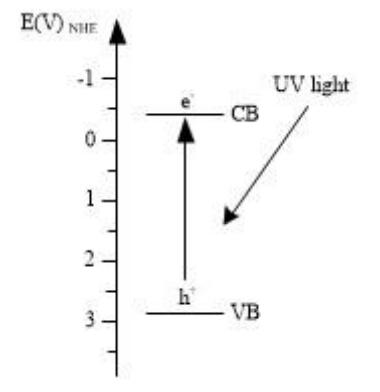
圖 2 TiO2 光照反應機制
二氧化鈦屬于過渡金屬氧化物,其相對密度與其結晶形態、粒徑大小、化學組分有關。 金紅石相是二氧化鈦最穩定的結晶形態, 致密的結構使其與銳鈦礦相比具有更高的硬度、密度、介電常數與折光率。 銳鈦礦型二氧化鈦的相對密度 3.8~3.9 g/cm3,金紅石型二氧化鈦的相對密度為 4.2~4.3 g/cm3。 由于金紅石相二氧化鈦單位晶格由兩個二氧化鈦分子組成,所以相比其由四個二氧化鈦分子組成的銳鈦礦相二氧化鈦來講,其單位晶格較小且更緊密, 所以具有較大的穩定性和相對密度, 因此具有較高的折射率和和介電常數及較低的熱傳導性。
由于二氧化鈦的介電常數較高,因此具有優良的電學性能。在外電場的作用下,其離子之間相互作用,形成了極強的局部內電場。在這個內電場的作用下,離子外層電子軌道發生了強烈變形,離子本身也隨之發生了很大位移。二氧化鈦晶型所含微量雜質等都對介電常數影響很大。金紅石型的介電常數隨二氧化鈦晶體的方向而不同:當與 C 軸相平行時,測得其介電常數 180;呈直角時為 90;其粉末平均值為 114。銳鈦型二氧化鈦的介電常數只有 48。
二氧化鈦具有半導體的性能,其電導率隨溫度的上升而迅速增加,而且對缺氧也非常敏感。如金紅石型二氧化鈦在 20 ℃時還是絕緣體,但加熱到 420 ℃時電導率增加了 107 倍;按化學計量組成的二氧化鈦( TiO2)電導率<10-10 s/m,而當二氧化鈦失去少量氧時, 如 TiO1.9995 的電導率卻有 10-1s/m。電子工業常利用金紅石相二氧化鈦的介電常數和半導體性質來生產陶瓷電容器等電子元器件。二氧化鈦無毒,化學性質很穩定,常溫下幾乎不與其他物質發生反應,是一種偏酸性的兩性氧化物。與氧、硫化氫、二氧化硫、二氧化碳和氨都不起反應,也不溶于水、脂肪酸和其他有機酸及弱無機酸,微溶于堿和熱硝酸,只有在長時間煮沸條件下才能完全溶于濃硫酸和氫氟酸。
納米二氧化鈦( TiO2)作為一種光催化劑,是一種性能優良的 N 型半導體納米材料, 可以充分利用太陽能,既高效節能又環保,并且在發生反應時表現出較好的光穩定性和較高的反應活性, 無毒,成本廉價, 無二次污染,是當前應用前景最為廣闊的一種納米功能材料。 被廣泛應用于廢水處理、空氣凈化、殺菌消毒、醫療技術和制備環保型材料等領域。







